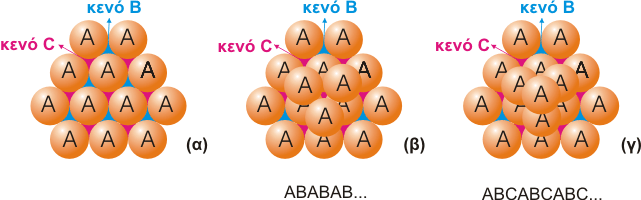
 |
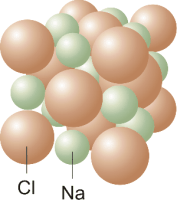 |
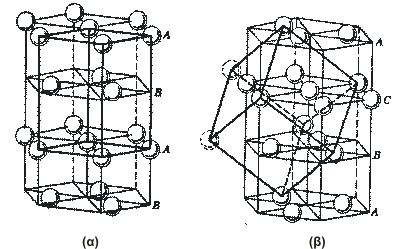
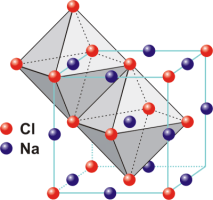
Σχήμα 1. Δομή του
NaCl. |
|
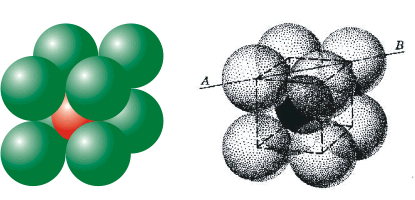
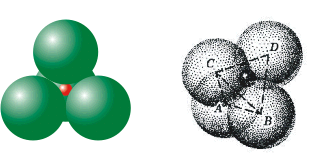
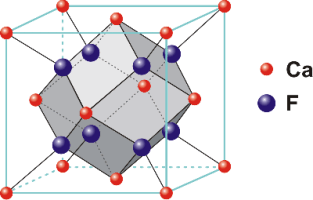
| Στο φθορίτη CaF2 κάθε
ιόν Ca2+ βρίσκεται στο κέντρο ενός
πολύεδρου συντάξεως που στις 8 κορυφές
του υπάρχουν ιόντα φθορίου F- (Α.Σ.=8).
Όμως κάθε ιόν φθορίου περιβάλλεται από 4
ιόντα ασβεστίου και επομένως αυτό έχει
αριθμό συντάξεως 4 (Α.Σ.=4), σε σχέση με το
ασβέστιο (Σχήμα 2). |
|
 |
|
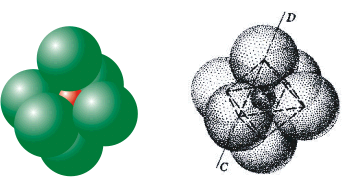
Σχήμα 2. Δομή του
φθορίτη. |
|
| Στο NaCl πρέπει να υπάρχει
ίσος αριθμός ιόντων χλωρίου και νατρίου
αφού ο αριθμός συντάξεως για τα ιόντα
αυτά είναι ίδιος, 6, σε συμφωνία και με το
χημικό τύπο του. Στο φθορίτη όμως επειδή
κάθε ιόν ασβεστίου περιβάλλεται από 8
ιόντα φθορίου, ενώ κάθε ιόν φθορίου από 4
ιόντα ασβεστίου υπάρχουν διπλάσια ιόντα
φθορίου σε σχέση με το ασβέστιο, πράγμα
που βρίσκεται σε συμφωνία τόσο με τον
τύπο του φθορίτη CaF2 όσο και με τα
σθένη του ασβεστίου και φθορίου.
Το γεγονός αυτό μας αναγκάζει να
παραδεχτούμε την ύπαρξη ενός πολύ
βασικού περιορισμού σύμφωνα με τον
οποίο: "Ο ολικός αριθμός των ιόντων
όλων των ειδών σε οποιαδήποτε σταθερή
δομή πρέπει να είναι τέτοιος ώστε ο
κρύσταλλος σαν σύνολο να είναι
ηλεκτρικά ουδέτερος". Δηλαδή ο
ολικός αριθμός των θετικών φορτίων
πρέπει να ισούται με το σύνολο των
αρνητικών φορτίων των ιόντων που
μετέχουν στην ένωση. |
|